Nejste přihlášen/a.
Dobrý den, nevíte, jak má výpadat titrační křivka, když titrujeme 10cm3 hydroxidu sodného kyselinou chlorovodíkovou (roztoky mají stejnou koncentraci -0,1mol*dm-3?
2x
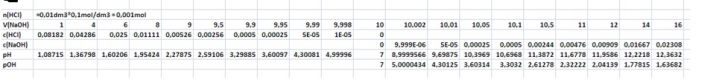
Na počátku máš HCl o c = 0,1M. Protože c(H3O+) = c(HCl) a pH = -log(cH3O+), můžeš počítat pH vzztahem
c(H3O+) = c(HCl) = (10-V(NaOH))*0,1/(10+V(NaOH) ; pH = -log(c(H3O+)
Těmito vztahy vypočítáš pH pro rostoucí přídavek NaOH až do objemu 9,998cm3 NaOH. Objem do vztahu dosazujeme v cm3.
Pro přídavek 10cm3 NaOH je kyselina právě neutralizována a protože jde o sůl silné kyseliny a silné zásady, je pH i pOH rovné 7. Nad hodnotou 10,002cm3 NaOH počítáme pH jinak. V roztoku bude přebytek NaOH. Z něj vypočteme c(OH-) a pOH a následně pH:
c(OH-) = (V(NaOH)-10)*0,1/(10 + V(NaOH)); pOH = -log(cOH); pH = 14 - pOH = 14 + log(c(OH-)
V excelu jsem spočítal tabulku, přikládám ji jako obrázek. Jen nevím, jak bude čitelná.
doplněno 26.01.14 22:45:Vztahy pro koncentraci HCl a NaOH v titrovaném roztoku nejsou obecné, platí jen pro konkrétní zadání, kdy ob roztoky mají stejnou koncentraci, 0,1M.
Dobrý den, chtěla bych se zeptat, zda titrace hydroxidu sodného kyselinou chlorovodíkovou znamená, že se do naoh přidává hcl nebo zda to znamená že se hcl přidává do naoh. Z výše uvedeného jsem pochopila, že počítáme, že se přídává naoh. Předem děkuji za odpověď.
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.