Zdravím, potřebovala bych vysvětlit pár příkladů, které nechápu. Díky moc. Zatím jen tu chemickou rovnováhu, později i redoxní reakace.
Dám se zadání a mé řešení některých příkladů, které jsem věděla. U některých příkladů vím odpověď, ale není mi jasné, proč je taková odpověď.
Takže:
5) Vím, že Kc = (produkt na stechiometrický koeficient / reaktant stechiometrický koeficient). Ale k čemu mě to bude? Jedině k vyjádření té konstanty. Jak určím typ reakce?
6) Rovnovážná konstanta Kc (dosazuji někam, nevím kam) rovnovážné koncentrace, u reakčního kvocientu dosazuji, zase nevím kam, aktuální koncentrace.
7) Odebereme produkt destilací? Zase nevím, proč...
8) Zvýšením teploty, na základě toho bych vysvětlila zvýšenou tvorbu CaCO3 ve varných nádobách, protože to tam vře.
9) Tady jsem schopná napsat rovnici: CH3COOH + H2O šipka tam a zpět CH3COO- + H3O+. A rovnovážná konstanta by byla Kc = (kys. octová * voda) / (octanový anion * H3O+). A jak bude disociační konstanat. Ta bude stejně?
10) Vodný roztok octanu sodného, rovnice CH3COONa + H2O šipka tam a zěpt CH3COO- + NaOH? Tím si nejsem jistá. Jaký bude mít efekt přidání kysel. octové? Jaké vlastnosti bude mít roztok? K těm vlastnostem mě napadá, nebude to pufr?
11) Tady to vůbec nevím, jenom vím, že když jde člověk do vyšší nadmožské výšky, je tam míň kyslíku, tudíž tělo musí tvořit více červených krvinek.
2x
Chemická rovnováha je důsledkem dvou protisměrných chemických reakcí. Mějme čistou vodu při teplotě 25°C. V ní probíhají současně dvě reakce:
H2O + H2O = H3O+ + OH- a současně H3O+ + OH-; to zapisujeme jako 2H2O <=> H3O+ + OH-
Aby mohla kterákoli z těchto dvou reakcí probíhat, musí dojít ke srážce příslušných dvou částic s dostatečnou energií. Pravděpodobnost, že k tomu dojde je tím větší, čím větší je počet částic v objemu, který reaktanty zaujímají - tedy čím větší je jejich molární koncentrace. S rostoucí koncentrací reaktantů vzniká stále více produktů a roste jejich koncentrace. S rostoucí koncentrací produktů (H3O+ a OH-) jich stále víc rekombinuje zpět na molekuly vody. Tak vzniká rovnováha, kterou popisuje rovnovážná konstanta:
Kc = c(H3O+)*c(OH-)/c(H2O)^2. Je to konstanta, podobně jako gravitační zrychlení nebo Avogadrova konstanta. V tomto případě bude Kc = 10^-7*10^-7/55,5^2 = 3,246*10^-18. Pokud uvažujeme o reakcích ve zředěných vodných roztocích, je látkové množství vody v 1dm3 a tedy i její koncentrace prakticky konstantní - 55,5mol/dm3 a můžeme ji tedy zahrnout do hodnoty konstanty. Rovnováhu pak popisuje často používaná verzen nazvaná iontový produkt vody Kw:
Kw = Kc*55,5^2 = c(H3O+)*c(OH-) = 10^-14 nebo lépe její záporný log pKw = -log(10^-14) = 14.
Přidáme nyní do 1 dm3 vody 0,0001mol KOH. KOH je silná zásada, ve vodném roztoku zcela disociovaná, takže
n(OH-) = n(KOH) = 0,0001mol. Protože Kw je konstanta, musí platit, že c(H3O+)*c(OH-) = 10^-14 a z toho plyne, že
c(H3O+) = 10^-14/10^-4 = 10^-10; pH = 10.
Mějme teď vodný roztok kyseliny HA, která disociuje: HA + H2O = H3O+ + OH- ; Kc = c(H3O+)*c(A-)/(c(HA)*c(H2O)) . Jako v předchozím platí, že c(H2O) je konstantní (zředěný roztok), takže koncentraci vody můžeme zahrnout do konstanty:
Ka = Kc*c(H2O) = c(H3O+)*c(A-)/c(HA) ;
Podíváme se, co se stane, když do čisté vody přidáme slabou kyselinu, třeba octovou tak, aby její analytická koncentrace byla 0,001mol/dm3. Její Ka je 1,82*10^-5. Malá část kyseliny bude disociovat. Bude tak malá, že koncentraci nedisociované kyseliny to prakticky neovlivní. Disociací vznikne stejné množství H3O+ a CH3COO-, takže za koncentraci aniontu můžeme dosadit koncentraci H3O+ a dostaneme:
Ka = c(H3O+)*c(H3O+)/c(CH3COOH) = c(H3O+)^2/0,001 = 1,82*10^-5 => c(H3O+) = √(1,82*10^-5*0,001) = √1,82*10^-8 = 1,35*10^-4.
pH = -log(1,35*10^-4) = 3,87
To pro začátek. Jasné?
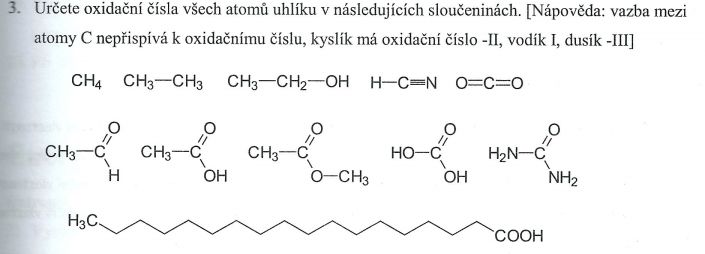
No, jestli bys se mnou nemohl probrat ty konkrétní příklady, jestli je řeším dobře a tak. A pak mám jeden velký problém v určování oxidačních čísel atomů C v organických sloučeninách.
doplněno 28.10.13 14:38:.
doplněno 28.10.13 14:44:
Jedu od CH4 doprava.
* -IV,
* -III a -III,
* -III a -I (tady nevím proč mínus jedna).
* tady sice vím, že vodík má I a dusík -III, ale k čemu mi to je? Uhlík v tom případě bude mít oxidační číslo -IV, aby byl seoučet oxidačních čísel roven nule?
* kyslíky mají oxidační čísla -II a -II, takže uhlík bude mít oxidační číslo IV, aby byl součet oxid. čísel nulový?
Druhý řádek, tady jsem kompletně ztracená u všech sloučenin. U té první bych možná určila oxidační číslo prvního uhlíku, což bude -III, ale to je asi tak všechno.
A poslední řádek, to už vůbec nevím.
CH3CH2OH: C1: 3*-1, 1*0 = -3; C2: 2*-1(H2),1*0(C),1*+1(OH) = -I
HCN: H+I; N -III ;C +II: I+II +(-III) = 0!
2*O(-II) C = 0 - 2*(-II) = IV. Součet ox. čísel v molekule je 0.
2. řádek CH3CHO: C1 -III; C2 1*-I(H) + 1*0(C) + 1*+II(=O) = +I; CH3COOH : C1 -III(3*H); C2 +III(1*O=, 1*O- z OH)
CH3COOCH3: C1 -III(H), C3 3*-I(H)+1*I = -II; C2 1*0,1*I(-O-)1*III(=O)
CO(OH)2 +IV: 2*I(-OH) + II(=O)
(NH2)2CO: Oba N -III, C2*I(-N) + 1*II(=O)
Je mi líto, ale to už je na mně momentálně příliš náročné. Je to už moc dávno, co jsem to studoval, a nikdy jsem s tím nepracoval.
36. Když delta E° <0V⇔ K mnohem menší než 1, reakce neběží doprava (běží opačně) . Když E°> 0V reakce jede samovolně doprava, K mnohem větší než 1, když =0V tak rovnováha, souvisí to s gibbsovou energií, všechno je to napsané v těch vzorečcích, jedná se ale o std stavy, takže záleží i na koncentracích atd.
37. nejdříve si musíš uvědomit, že ty E° jsou většinou uváděny jako redukční potenciály. Najdi si v tabulkách ještě potenciál Fe3+ na Fe2+ a pak budem pokračovat
- Výpočty látkové množství
- Látkové množství - příklad-jak vypočítat
- Výpočty molární hmotnost látkové množ
- Fyzika-kruhovy dej s id. plynem-přiklady
- Chemické výpočty-9.ročník
- Molární hmonost, látkové množství
- Přiklad - titrace
- Kys. sírová výpočet
- Úloha z chemie
- Látkové množství plynu
- Hmotnost a množství
- Faradayovy zákony
- Hmotnostní zlomek
- Výpočet hmotnosti roztoku
- Chemie přiklady srážecí titrace
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.