Nejste přihlášen/a.
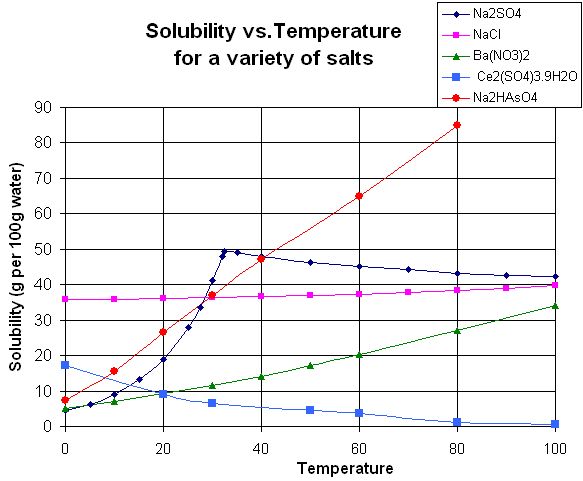
Ahoj, dělali jsme ve škole lab. cvičení, uděali jsme při 50 stupních celsia 25ml nasycený roztok vody a Na2SO4.A poté jsme to nechali zchladit a vznikli nám krystalky.A otázkou je, jak by probíhal pokus, kdyby jsme místo Na2SO4 použili NaCl.
doplněno 07.10.12 18:17:Tento graf jsme k tomu dostali.
3 odpovědi na otázku
Řazeno dle hodnocení
Přihlásit se k odběru odpovědí z této otázky:
Otázky na téma nasycený roztok
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.
Copyright © 2004-2026 Poradna Poradte.cz. Všechna práva vyhrazena. Prohlášení o ochraně osobních údajů. | [tmavý motiv]