Nejste přihlášen/a.
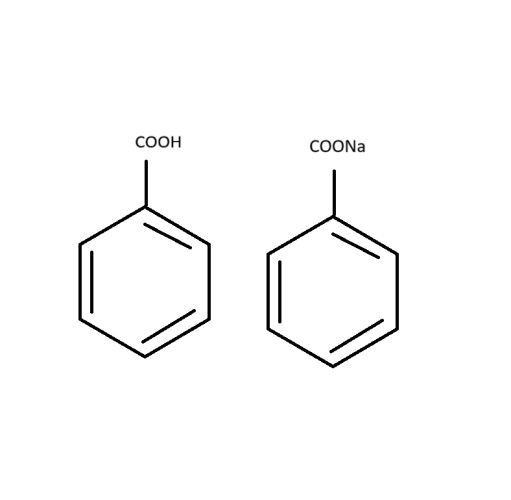
Když jsem dělala cvičení, tak jsem si myslela, že to bude COOh, ale ve výsledcích jsem zjistila, že je to ta druhá a nemůžu přijít na to proč.
Děkuji za odpověď
0x
Obecně platí, že sodné soli (sůl obsahující sodík, Na+) jsou obvykle více rozpustné ve vodě než odpovídající karboxylové kyseliny. To je způsobeno tím, že sodné soli mohou vytvářet ionty v roztoku, což zlepšuje jejich schopnost být obklopeny vodními molekulami a být tak lépe rozpustné. Karboxylové kyseliny (COOH) jsou obecně méně rozpustné ve vodě, protože mají tendenci tvořit vodíkové vazby mezi svými molekulami, což snižuje jejich schopnost rozpouštět se v polárním prostředí, jako je voda.
Takže, pokud porovnáváte rozpustnost ethanoanu (CH3COONa) a kyseliny octové (CH3COOH), ethanoan sodný by měl být více rozpustný ve vodě než kyselina octová.
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.