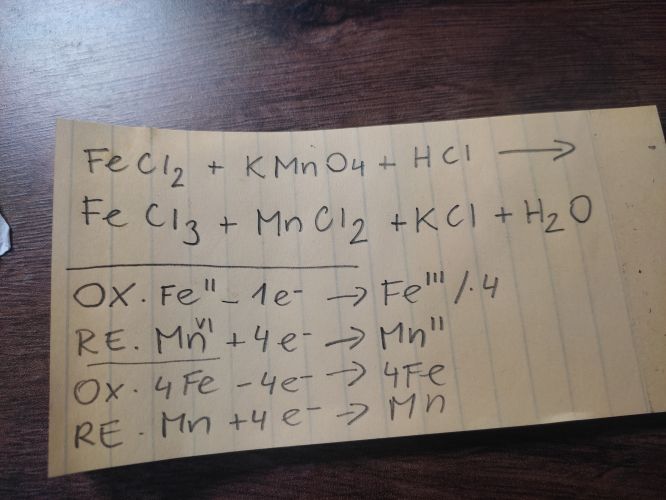Nejste přihlášen/a.
0x
E-ChemBook: Chemické rovnice /...
Já osobně to řeším tou složitější matematickou cestou:
a.FeCl2 + b.KMnO4 + c.HCl → d.FeCl3 + e.MnCl2 + f.KCl + g.H2O
Fe: a = d
Cl: 2a + c = 3d + 2e + f
K: b = f
Mn: b = e
O: 4b = g
H: c = 2g
2a + 2g = 3a + 2b + b
2a + 8b = 3a + 3b
a = 5b
Zvolíme b = 1:
a = 5
c = 8
d = 5
e = 1
f = 1
g = 4
5 FeCl2 + KMnO4 + 8 HCl → 5 FeCl3 + MnCl2 + KCl + 4 H2O
0x
Máš zásadní chybu v ox.č. Mn:
Oxiduje se Fe(II) = Fe(III) + e a redukuje se Mn(VII) + 5e = Mn(II); s pomocí těchto polorovnic sestavíme rovnici reakce. Počet HCl, které zajišťují prostředí, upřesníme v druhém kroku. Křížovým využitím počtů elektronů dostaneme hlavní reaktanty:
5FeCl2 + KMnO4 + xHCl = 5FeCl3 + KCl + MnCl2 + yH2O. Na levé straně je 10Cl-, na pravé je 18. Ty dodá HCl:
5FeCl2 + KMnO4 + 8HCl = 5FeCl3 + KCl + MnCl2 + 4H2O.
OK?
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.