0x
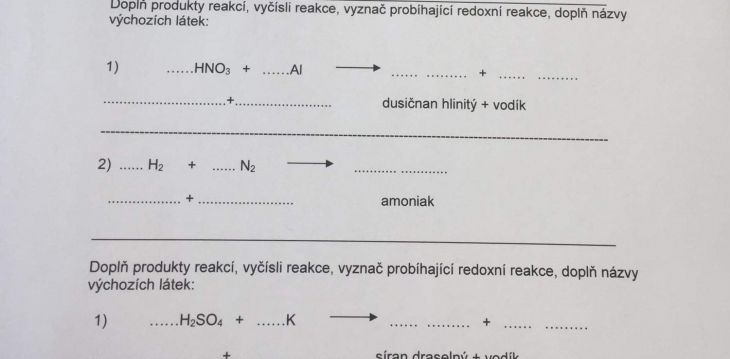
6 HNO3 + 2 Al → 2 Al(NO3)3 + 3 H2
3 H2 (g) + N2 (g) → 2 NH3 (g)
Kyseliny: dusičná, sírová, chlorovodíková, prvky: vodík, dusík, draslík, zinek
Oxidace Je poloreakce, při níž dochází ke zvyšování oxidačního čísla prvku. Prvek při ní ztrácí elektrony.
Redukce Je poloreakce, při níž dochází ke snižování oxidačního čísla prvku. Prvek při ní získává elektrony.
0x
Nevím, jak by měl podle autora zadání vypadat výsledek, ale přesto to zkusím:
1: 6HNO3 + 2Al = 2Al(NO3)3 + 3H2; Oxidace: Al = Al(III) + 3e; Redukce 2H+ + 2e = H2
Kyselina dusičná + hliník
2: 3H2 + N2 = 2NH3; Oxidace: 3H2b = 6H+ + 6e; redukce N2 + 6e = 2N(-III)
Vodík + dusík
3: H2SO4 + 2K = K2SO4 + H2; oxidace: 2K = 2K+ + 2e; redukce 2H+ + 2e = H2
kyselina sírová + draslík
4: 2HCl + Zn = ZnCl2 + H2; oxidace: Zn = Zn++ + 2e; redukce: 2H+ + 2e = H2
Kyselina chlorovodíková + zinek
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.