Dobrý den,
v sešitě jsem našel pomůcky, jak určit oxidační stavy jednotlivých prvků, bohužel již si nevzpomínám na samotný princip určení.
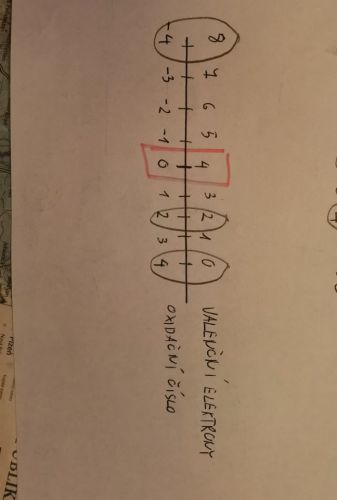
Postup byl nasledující, např. pro atomu uhlíku
1. nakreslím osu, horní část budou valenční elektrony a dolní část oxidační stavy
2. popíši dolní osu od -4 do 4
3. do hodní osy zapíšu 4 jako počet valenčních elektronů v oxidačním stavu 0 a doplním zbylá čísla
4. vznikla mi dvojice 4 a 0
5. jak jsem určil zbylé dvojice? (8 a -4; 2 a 2; 0 a 4)?
Mám tam poznámku, že prvky chtějí dosáhnou sudého čísla a toho dosáhnou pouze kombinací sudé číslo + sudé číslo nebo liché číslo + liché číslo.
Děkuji za reakci
0x
Obávám se, že úplně nechápu způsob určení, o ktereém píšeš. Jdu na to jinak. Jsou valenční orbitaly a na nich valenční elektrony. Počet valenčních elektronů udává maximální možný kladný oxidační stav, počet elektronů, které mohou doplnit volné valkenční elektrony, udává maximální oxidační stav. U prvků třetí a vyšších period se mohou vazeb účastnit kromě orbitalů s a p ještě 2 orbitraly nd u nepřechodných prvků a u přechdných prvků ještě orbitaly (n-1)d., Když si vezmeme kyslík, má 4 valenční orbitaly a na nich 6 elektronů. Pro zaplnění všech valenčních orbitalů přijme 2 elektrony, má tedy max. ox.č. -II. Mohou také vytvořit vazby s elektronegativnějším fluorem a budou mít ox.č. II.Naproti tomu síra a vyšší prvky šesté skupiny mohou využít ještě dva orbitaly nd, mají proto stejně jako kyslík ox.č. -II, ale kladné ox.č. VI.
Tak to by bylo na úvod.
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.