Prosim jak to mám udělat? Děkuji moc!
0x
Ahoj, uvědom si, že na katodě dochází k redukci a na anodě k oxidaci.
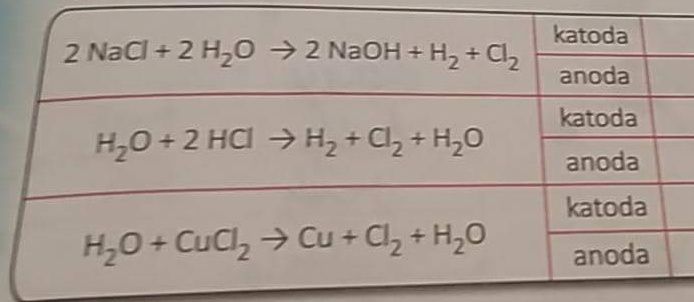
Tak třeba první příklad je elektrolýza vodného roztoku chloridu sodného, kdy na katodě dochází k redukci vody (voda se redukuje snáz než sodík, má vyšší redukční potenciál) za vzniku hydroxidu sodného a uvolnění vodíku, a na anodě zas probíhá oxidace chloridových aniontů za vzniku plynného chloru.
Napsal bych to asi takhle:
katoda: 2 H2O + 2 elektrony ---> H2 + 2 OH-
anoda: 2 Cl- - 2 elektrony ---> Cl2
doplněno 22.06.18 14:41:
A co přesně nechápeš? Je to stejné. Na katodě (záporný pól) se redukuje vodík a na anodě (kladný pól) se oxiduje chlor.
0x
V roztoku vznikají ionty,Zde ionty Na+ a Cl- -Z vody iont H+ a OH- Ty se redukuji tedy přijímají elektrony a také oxidují,tedy elektrony předávají.To znamená,že iont který má elektron navíc předá ho iontu,kde elektron chybí.Tím vzniknou součeniny neutrální.
Pokud směs elektrolyzujeme,pak putují ionty k elektrodám s opačnou polaritou a tam se neutralizují a vzniká přímo prvek.Ten se na elektrodě vyloučí,nebo reaguje s vodou.
To znamená u rovnice 1,vzniká Na ,ten se sloučí s vodou a v druhém stupni vzniká NaOH.
U druhé rovnice se na jedné elektrodě vyloučí Cl spojí se na Cl2 a vybublá ven.na druhé elektrodě vzniká stejným způsobem H,opět se sloučí a vytvoří H2 a vybublá.
U třetí rovnice se zase na jedné elektrodě vyloučí Cl,d va atomy se spojí a Cl2 vybublá.Ovšem na druhé elektrodě se vyloučí Cu a zůstane.
Identifikaci elektrod musíš provést sám.(a)
JABRAKA
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.