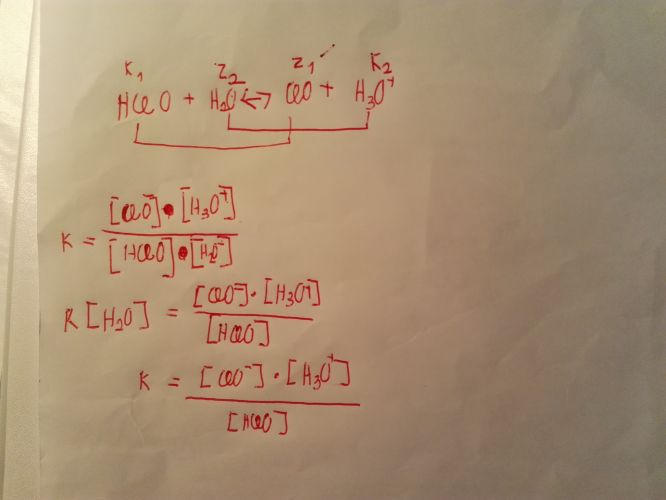Nejste přihlášen/a.
Dobrý den, když mám toto zadání
Zapište rovnici disociace kyseliny chlorné ve vodě. Vyznačte konfigurované páry. Zapište rovnici rovnovážnou konstantou této reakce a odvoďte disociační konstantu kyseliny
Mám to dobře? Ještě bych se chtěl zeptat, jak jsme přesunul vodu na levou stranu rovnice ke konstantě, tak v druhým kroku se nepíše, protože když vynásobím konstantu voda zmizí?
_________
Když určuji sílu kyseliny, záleží na poměru mezi kyslíkem a vodík, jak to, ale bude v tomto případě? Jsou stejně silné?
H2CO3 H2SiO3
Děkuji
0x
Udělal jsi to správně. Ta koncentrace H2O se může zahrnout do disociační konstanty proto, že disociační konstanta se zabývá chováním kyselin v roztocích, kde je koncentrace vody velmi blízká hodnotě 55,5 mol/dm3 takže je možné ji považovat za konstantu. Pak bude platit, že Ka = K*55,5.
Pokud se týká síly kyselin, zmíněné pravidlo je jen hrubý odhad a většinou platí jen pro kyseliny téhož prvku ve kterých je různé jho ox. číslio. Ve tvém příkladi je H2CO3 podstatně silnější při disociaci do prvního stupně, ale výrazně slabší než H2SO3. A H2SiO3 je prakticky stejně silná jako H4SiO4 při disociaci do prvních dvou stupňů, viz tabulky disociačních konstant.
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.