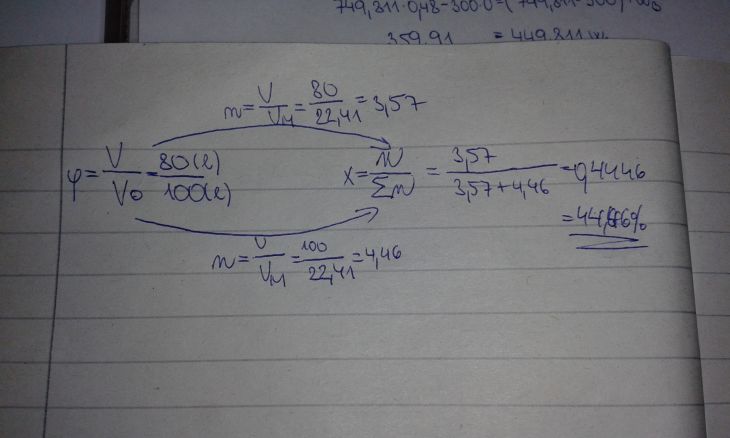
Jaké je mol. % jednotlivých složek plynu, který obsahuje 80 obj. % CO a 20 obj. % H2?
Vypoočítala jsem molární procento pro oxid uhelnatý, ale s výsledkem u zadání nesedí.
Našel by někdo mou chybu?
0x
Já vím, že molární zlomek a objemový u PLYNŮ je stejný, ale co kdybych tam měla něco jiného než plyn.
Plyny, na rozdíl od něčeho jiného, mají přibližně stejný molární objem. To na příkladpro kapaliny neplatí a navíc u mísitelných kapalin a obecně u roztoků, není objem směsi rovný součtu objemů složek, muže být menší nebo větší. Proto nezbgýván než počítat molární zlomky přepočtem z hmotností složek.
Ale když bych chtěla přepočítat objemový na hmotnostní, tak k tomu potřebuji i hustotu. A tu v zadání nemám.
Pokud považuješ oba plyny za dostatečně blízké ideálnímu plynu a znáš objemový ( = molární ) zlomek, stačí ti molární hmotnosti. Molární zlomek každého z obou plynů vynásobíš jeho molární hmotností a celková hmotnost molu směsi bude součtem takových hmotností:
M(CO) = 28g/mol; M(H2) = 2g/mol; m(CO) = 0,8*28 = 22,4g; m(H2) = 0,2*2 = 0,4g. M(Směs) = 22,8g/mol
Hmotnostní % jsou %CO) = 100*22,4/22,8 = 98,25; %H2 = 100* 0,4/22,8 = 1,75%
Samozřejmě jde o plyny, takže důležité jsou podmínky - teplota a tlak. Co jsem počítal, platí pro standaední podmínky, 101325Pa a 0°C.
Stačí?
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.