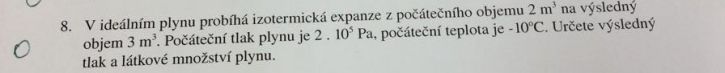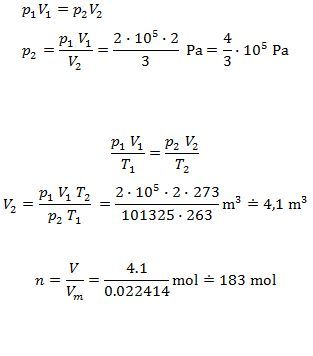Dobrý den, může mi prosím někdo poradi vzorec, ze kterého určím látkové množství plynu?
Mám zadán příklad viz obrázek.
tlak p2 mi vyšel 133 333 Pa je to výsledný tlak? a jak teď to látkové množství? znám jen vzorce:
n=N/Na
n=m/M
děkuji
doplněno 04.01.15 17:56:moooooc se omlouvám, dala jsem omylem jiné zadání. Správné je zadání 8!
0x
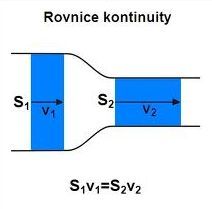
Jaké látkové množství plynu? Má se určit rychlost proudění v užším průměru. Použij rovnici spojitosti (kontinuity) toku.
Pro výpočet rozdílu tlaků použij Bernoulliho rovnici.
0x
Použij Boylův–Mariottův zákon: p1V1 = p2V2
Pak použij stavovou rovnici a vypočti, jaký objem bude při teplotě 0 °C = 273,15 K a tlaku 101 325 Pa.
Jeden mol plynu (molární objem) za těchto podmínek má objem 22,414 dm3.
Zjistíš, kolikrát je objem plynu větší než molární objem a získáš tak látkové množství.
Protože molární objem Vm = 0,022414 m3⋅mol-1 je udán za teploty 0 °C = 273,15 K a tlaku 101 325 Pa Proto jsem počítal, jaký bude objem plynu při 0 °C = 273,15 K a tlaku 101 325 Pa.
Nebo to lze řešit, jako to řešil @jojozka.
děkuji, ještě mám takový blbý dotaz, proč když jste v první rovnici spočitál p2= 133 333.
tak ve druhé rovnici za p2 dosazujete uplně jiné číslo?
T1 a T2 jsou rozdílné teploty? myslela jsem, že u izotermického se nemění
Vm je pak co?
Ze stavové rovnice p*V = n*R*T vypočítáš n = p*V/(R*T) = 2m3*263,15K/(8,3145*263,15K) = 182,82mol
p2 = n*R*T/V = 182,82*8,3145*263,15/3 = 133,334kPa.
doplněno 05.01.15 23:05: Ten první řádek je špatně. Má býtZe stavové rovnice p*V = n*R*T vypočítáš n = p*V/(R*T) = 2m3*2*10^5Pa/(8,3145*263,15K) = 182,82molChybička se vloudila při přepisu z poznámek. Omlouvám se.
- Výpočty látkové množství
- Látkové množství - příklad-jak vypočítat
- Výpočty molární hmotnost látkové množ
- Fyzika-kruhovy dej s id. plynem-přiklady
- Chemické výpočty-9.ročník
- Molární hmonost, látkové množství
- Přiklad - titrace
- Kys. sírová výpočet
- Úloha z chemie
- Hmotnost a množství
- Faradayovy zákony
- Výpočet hmotnosti roztoku
- Hmotnostní zlomek
- Chemie přiklady srážecí titrace
- Výpočet titrace do chemie
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.