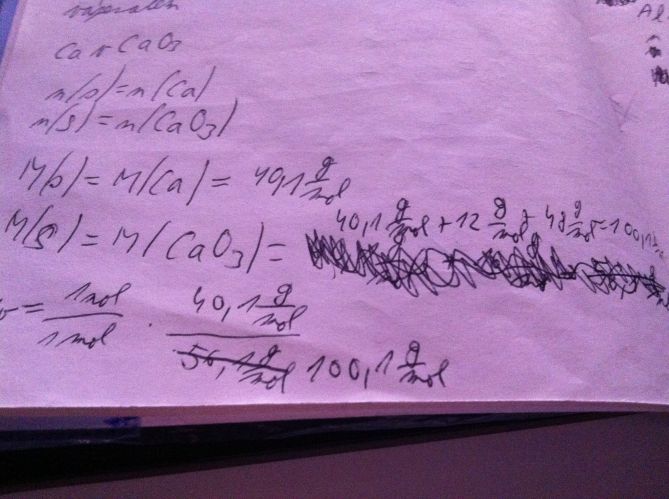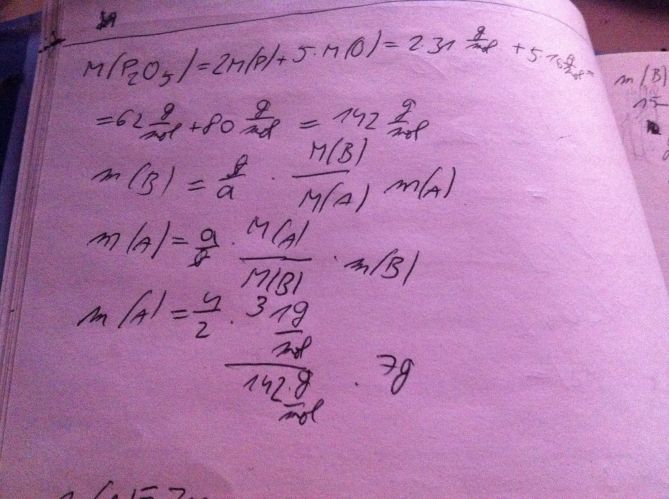Nejste přihlášen/a.
U toho 1. obrázku vůbec nechápu, kde se vzalo těch 48 g/mol a potom jak je tam to w= 1mol/1mol, tak jak poznám, že tam má být 1 mol a ne 2?
A u toho 2. obrázku chápu vlastně jenom ty 2 řádky, potom už vůbec nechápu kde se dole vzala ta čísla.
Moc prosím aby mi to někdo vysvětlil, doufám že jsou vidět ty obrázky, píšu to přes mobil.
2x
A jsi si jistá tím CaO3? Něco takového totiž vůbec neexistuje. To spíš bude CaCO3, tomu by pak odpovídala i ta molární hmotnost. (Budu tedy počítat s tím, že to má být CaCO3)
1. Těch 48g/mol je molární hmotnost kyslíku v CaCO3, takže M(CaCO3=40,1+12+3*16=101,1g/mol
A u toho w - to spočítáš tak, že hmotnost složky, pro kterou to chceš zjistit (Ca) vydělíš hmotností celé té látky (CaCO3). Ve sloučenině máš jenom jeden atom Ca, tak proto je to 1mol/1mol. (Kdybys třeba počítala obsah draslíku v K2CO3, tak to bude 2mol/1mol).
A nemáš někde zadání toho druhého? Takhle moc nevím, co máš spočítat.
2x
U prvního příkladu je hlavní potíž v tom, že výpočty odpovídají podílu Ca v CaCO3 (uhličitanu vápenatém): 40,1g/mol je Ca, 12g/mol je C a 48g/mol je 3x O. Sloučenina CaO3 vůbec nebude držet pohromadě, to je nesmysl. Vztah w= ... říká, že hmotnostní zlomek (podíl) se spočítá z hmotností 1molu prvku (Ca, tj. 40,1g) a 1molu sloučeniny (CaCO3, tj. 100,1g), podíl molárních hmotostí je rozšířen 1mol asi jen formálně kvůli úpravě jednotek.
2. příklad je zapsaný od půlky, samým začátkem je pravděpodobně rovnice oxidace 4P + 5O2 --> 2 P2O5.
Molární hmotnosti M(A) = M(P) = 31g/mol a M(B) = M(P2O5) = 2*31 + 5*16 g/mol = 142g/mol se vezmou z (Mendělejevovy) periodické tabulky prvků jako hmotnostní čísla. a=4 a b=2 jsou počty molekul P a P2O5 vstupujících, resp. vystupujících z reakce, zároveň je to poměr látkových množství (oxidací 4mol fosforu vzniknou jen 2mol oxidu). m(A) = 4/2 * 31/142 g/mol * 7g se pak dá vyložit jako hmotnost fosforu (P), který musí vstoupit do rekace, aby vzniklo m(B)=7g oxidu fosforečného (P2O5), na což asi byla původní otázka.
Co se chemie týče, najdi si doučování, čím dřív, tím lépe. Na netu je několik serverů s doučovateli.
doplněno 24.11.14 23:24:Není zač, mám radost, že to chápeš, i že máš chuť do toho doučování. Za chvíli to budeš mít v paži a není vyloučeno, že se vypracuješ z propadání na jedničku, jakmile to pochopíš, bude se to zdát naráz lehké a někdy i zajímavé a pak se přijď pochlubit. Teta Dežaví tě podrbe za uchem a pochválí. ![]() Doučovatelských serverů je hodně, nevím, odkud jsi, dala bych sem konkrétní odkazy pro ten daný okres nebo město, lze se i doučovat na dálku po skype, ale zrovna u chemie to je trochu náročnější. Když budeš něco potřebovat, je lepší příště přijít hned odpoledne, ať se to stihne vyřešit a ty to pochopíš, bude se ti líp usínat.
Doučovatelských serverů je hodně, nevím, odkud jsi, dala bych sem konkrétní odkazy pro ten daný okres nebo město, lze se i doučovat na dálku po skype, ale zrovna u chemie to je trochu náročnější. Když budeš něco potřebovat, je lepší příště přijít hned odpoledne, ať se to stihne vyřešit a ty to pochopíš, bude se ti líp usínat. ![]()
0x
Já se v chemii, už také nevyznám, ale nemůžeš zajít třeba za jinou učitelkou, jestli by ti to nevysvětlila?
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.