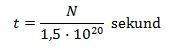Nejste přihlášen/a.
Dobrý den,
potřeboval bych trochu poradit.
____________________________________________________________________________________
Mm - molární hmotnost - jednotka g/mol (jak je to kdybych převáděl na kg/mol?)
n - látkové množství - jednotka mol
N -? -?
NA -? -?
____________________________________________________________________________________
Úloha
V uzavřené nádobě ve vakuu je plynný oxid uhličitý o hmotnosti 1,1 kg. Vadným uzávěrem uniká z nádoby za dobu 1s průměrně 1,5 .1020 mol CO2.
Za jako dobu uniknou z nádoby všechny molekuly?
1. M(CO2) = 44 mol
2. n = m/M = 0,025mol
Jak mám postupovat dál?
____________________________________________________________________________________
Moc děkuji za odpověd.
2x
Vypočítejte jaké látkové množstvI představuje 18.10^23 molekul vodiku. Jaké látkové množství představuje stejný počet molekul kyslíku 6.10^23.
doplněno 11.09.14 21:26: Úplně poslední otázka. Jaká jednotka se líše za N? mol?
U N se obvykle jednotka neuvádí. Je to počet. V textu se napíše třeba N = 10^19 částic (molekul, atomů...).
Ještě připomínám: mol z definice nutně neznamená, že jde o částice stejného druhu. V našem příkladu s vodou můžeme také říct, že 1 mol vody obsahuje 3 moly atomů. Ale můžeme mluvit o 1 molu vzduchu. Pokud u podobných směsí potřebujeme spočítat molární hmotnost, počítáme ji jako vážený průměr molárních hmotností složek. Tak u toho vzduchu, když budeme uvažovat přibližné složení v objemovém nebo molárním zlomku (u plynů) 79%N2 a 21%O2 by molární hmotnost byla 0,79*M(N2) + 0,21*M(O2). Občas se na těchto vztazích vyskytují úlohy na složení směsí
.Stejný počet molekul znamená stejné látkové množství, dokonce i pokud jde v jednom z případů o molekuly směsi
n = N/NA = 18*10^23/6,022*10^23 = 2,989mol.
0x
N – počet molekul
NA – Avogadrova konstanta
Mm(CO2) = 44 g/mol = 0,044 kg/mol
n = 1,1/0,044 mol = 25 mol
?
Vadným uzávěrem uniká z nádoby za dobu 1s průměrně 1,5 .1020 mol CO2.
Nemá tam být: 1,5 .1020 molekul CO2?
N = n⋅NA
Pak již stačí tento počet vydělit číslem 1,5 .1020.
- Výpočty látkové množství
- Látkové množství - příklad-jak vypočítat
- Fyzika-kruhovy dej s id. plynem-přiklady
- Výpočty molární hmotnost látkové množ
- Chemické výpočty-9.ročník
- Přiklad - titrace
- Kys. sírová výpočet
- Úloha z chemie
- Látkové množství plynu
- Hmotnost a množství
- Faradayovy zákony
- Výpočet hmotnosti roztoku
- Hmotnostní zlomek
- Chemie přiklady srážecí titrace
- Výpočet titrace do chemie
- Výpočty molární hmotnost látkové množ
- Molární hmotnost
- Výpočet chem. příkladu (molární hmotnost)
- Výpočet molární hmotnosti CO2
- Molární hmotnost sloučeniny?
- Látková koncentrace - výpočet
- Výpočet parciálních tlaků
- Molární hmotnost - výpočty
- Pomoc! termochemie - spěchá
- Výpočty z chemických rovnic - divné zadání?
- Přiklad - titrace
- Molární hmotnost CO2
- Molární hmotnost helia - jak odvodit
- Kolik molekul v 126,9045g jodu?
- Molární hmotnost atomu
Neneseme odpovědnost za správnost informací a za škodu vzniklou jejich využitím. Jednotlivé odpovědi vyjadřují názory jejich autorů a nemusí se shodovat s názorem provozovatele poradny Poradte.cz.
Používáním poradny vyjadřujete souhlas s personifikovanou reklamou, která pomáhá financovat tento server, děkujeme.